最新!3月重點醫藥政策盤點
一、本月國家部委發文政策收集統計
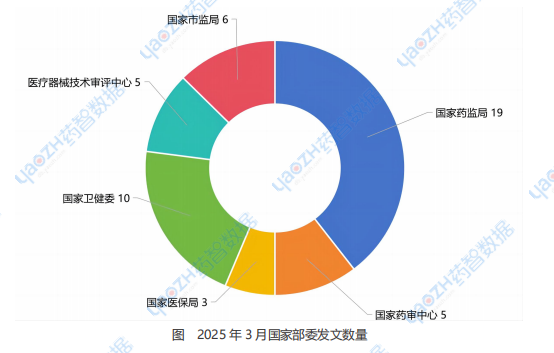
2025年3月,藥智網收集的國家藥監局發文政策19條;國家藥審中心發文政策5條;國家醫保局發文政策3條;國家衛健委發文政策10條;醫療器械技術審評中心發文政策5條;國家市場監督管理局發文政策6條。
二、本月醫藥政策速覽
藥品類
數據來源:藥智數據-政策法規數據庫
醫療器械類

數據來源:藥智數據-政策法規數據庫
其他類

數據來源:藥智數據-政策法規數據庫
藥品類重點法規梳理:
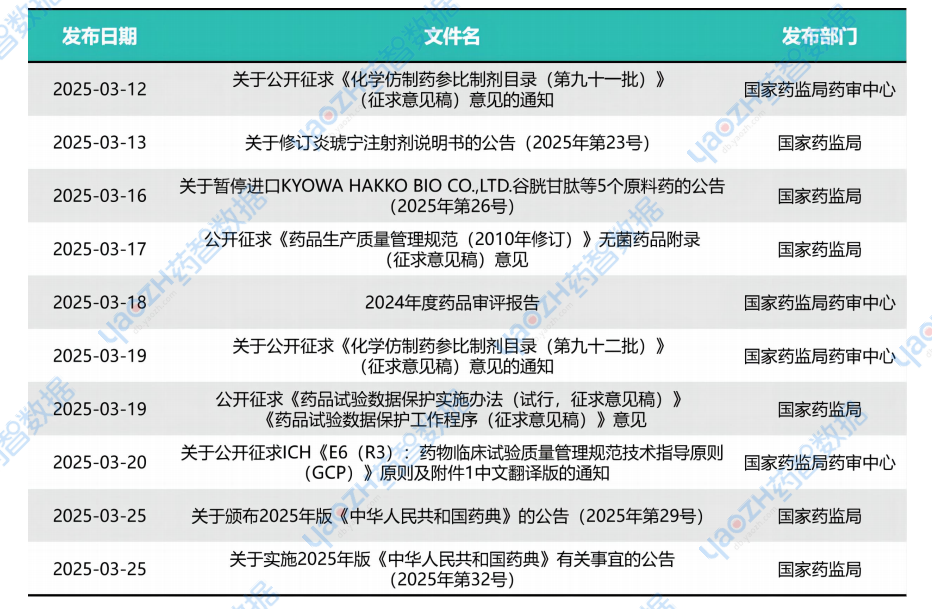
1. 國家藥監局綜合司公開征求《藥品生產質量管理規范(2010年修訂)》無菌藥品附錄(征求意見稿)意見
國家藥監局近期發布的《藥品生產質量管理規范(2010年修訂)》無菌藥品附錄(征求意見稿)對現行規范進行了全面修訂,旨在提升無菌藥品生產的質量安全水平,并與國際標準接軌。以下是相較于現行版本(2011年版)的主要變化點:
(1)條款與術語全面擴充
條款增量:由81條躍升至235條,細化要求更精準。
術語拓展:從6個增至33個,新增“細菌截留試驗”等關鍵術語。
(2)適用范圍進一步拓寬
明確將無菌輔料及直接接觸藥品的無菌包裝材料生產納入規范。
(3)污染控制策略(CCS)全新引入
要求企業建立涵蓋多方面的CCS,并定期審核更新,確保污染預防效果。
(4)潔凈區與設施標準升級
分級細化:明確A級至D級潔凈區風險等級。
技術革新:鼓勵使用隔離器、RABS等先進技術,減少人為干預。
氣流研究:A級區需進行靜態和動態氣流深入研究。
(5)人員管理力度加強
A/B級區人員需定期無菌更衣確認及氣流可視化培訓。
減少潔凈區人員數量,規范操作行為,確保環境穩定。
(6)生產與滅菌管理細化升級
滅菌工藝優先:首選最終滅菌,必要時采用除菌過濾并驗證完整性。
技術管理細化:明確FFS、BFS等特定技術要求。
無菌工藝模擬:模擬最差條件,驗證無菌工藝有效性。
(7)質量控制與監測全面強化
環境監測數據成為批次放行重要依據。
鼓勵采用已驗證的自動化微生物檢測方法。
無菌檢查結合環境監測數據,確保產品安全。
(8)包裝容器密封性要求優化
熔封產品根據容量制定不同測試標準。
非熔封產品需基于風險評估制定抽樣計劃。
(9)5.0μm粒子標準調整
A級區不再強制要求靜態和動態監測5.0μm粒子,適應新標準。
(10)與國際標準接軌
參考歐盟GMP附錄1(2022版),引入CCS、PUPSIT等國際概念,推動規范國際化。
2. 國家藥監局綜合司公開征求《藥品試驗數據保護實施辦法(試行,征求意見稿)》《藥品試驗數據保護工作程序(征求意見稿)》意見

圖片來源:NMPA官網
《藥品試驗數據保護實施辦法(試行,征求意見稿)》和《藥品試驗數據保護工作程序(征求意見稿)》的出臺,標志著我國藥品試驗數據保護制度的正式建立,這一制度的建立,將為醫藥創新提供更加有力的法律保障,促進醫藥行業的高質量發展。以下是兩份征求意見稿的核心內容、創新點、實施機制及政策意義。
(1)核心內容
保護對象:創新藥、改良型新藥、仿制藥分類保護,覆蓋化藥和生物藥。
保護期限:
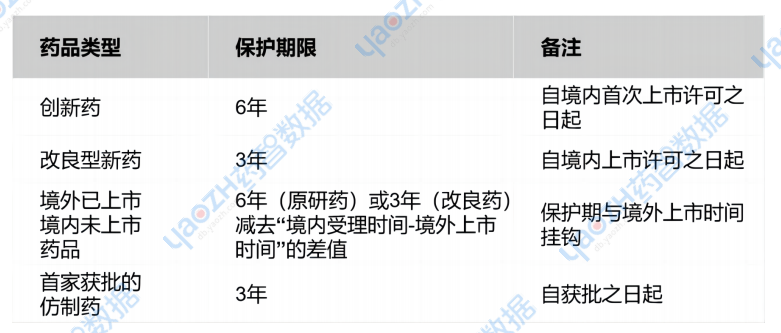
保護范圍:安全性、有效性、質量數據(不含BE/免疫原性數據)。
(2)政策亮點
覆蓋生物藥:CAR-T、單抗等納入保護。
適應癥獨立保護:同一藥品不同適應癥可分別申請。
鼓勵全球同步:境外藥品在華保護期與海外上市時間掛鉤。
數據資產化:允許原研企業授權仿制藥企使用數據。
(3)實施機制
申請公示:上市申請時同步提交,CDE公示保護信息。
保護期限制:仿制藥企未經許可依賴原研藥受保護數據者不予批準。
終止情形:藥品撤銷或持有人放棄時保護終止。
(4)政策意義
激勵創新:數據獨占彌補專利保護不足。
仿制平衡:允許保護期結束前1年提交仿制申請。
國際對標:參考美歐數據保護模式,符合WTO規則。
3. 國家藥監局 國家衛生健康委關于頒布2025年版《中華人民共和國藥典》的公告(2025年第29號)、國家藥監局關于實施2025年版《中華人民共和國藥典》有關事宜的公告(2025年第32號)
圖片來源:NMPA官網
2025年版《中華人民共和國藥典》(以下簡稱《中國藥典》),以及藥典實施有關事宜的公告已由國家藥監局、衛健委頒布,自2025年10月1日起實施。
聲明:本文觀點僅代表作者本人,不代表本網站立場,歡迎在留言區交流補充;如需轉載,請務必注明文章作者和來源。如涉及作品內容、版權和其它問題,請在本平臺留言,我們將在第一時間處理。



 江西仁和中方醫藥股份有限公司
All Rights Reserved
江西仁和中方醫藥股份有限公司
All Rights Reserved